
A gyakorlat során bepillantás nyerhető a sejttenyésztés módszerébe, az élő sejtek megfigyelését lehetővé tevő fáziskontraszt-mikroszkópiába, a számítógépes mérésirányítás lehetőségeibe és a statisztikai módszerek biológiai felhasználásába.
A szövetes testszerveződésű élőlények bizonyos szöveteinek vagy sejtjeinek élő, működő állapotban történő megfigyelése nehézségekbe ütközik. Ezért gyakran különböző modellrendszereket is tanulmányoznak, amelyekben az élőlényekből származó sejteket, szöveteket megpróbálják in vitro a fiziológiás állapotokat minél jobban megközelítő körülmények között tartani, illetve amennyiben osztódni is képesek, akkor tenyészteni. A sejttenyészetekkel nyert adatok elemzésénél azonban mindig figyelembe kell venni, hogy a sejtek közötti intercelluláris illetve a sejtközti térben található extracelluláris hálózatok molekuláris kapcsolatai a tenyésztés során nem vagy csak részben alakulnak ki. Ez okozza az in vitro és az in vivo vizsgálatok közötti egyik legfontosabb különbséget.
A sejttenyésztés olyan termosztált tápoldatban történik, amely a megfelelő mennyiségben tartalmaz szervetlen ionokat (Ca2+, Mg2+, Na+, K+, SO42-, Cl-, és H2PO4-, HPO42-), aminosavakat (legnagyobb mennyiségben L-glutamint, ami a sejtek legfontosabb nitrogénforrása), B-vitaminokat és szénhidrátokat (glükóz). A fentieken kívül gyakran különböző oldott gázokat (CO2,O2) is biztosítanak a szövetnedv összetételének megfelelően: a sejteket 5% CO2 és 95% levegő keverékében tartják. A megfelelő pH kialakításában szerepet játszik egyrészt a foszforsav savmaradékionjai által alkotott pufferrendszer (NaH2PO4-por oldása), másrészt a karbonátionok alkotta pufferrendszer (NaHCO3 hozzáadása). Ezek segítségével 7,6 körüli pH értéket állítanak be, amely a megfelelő parciális nyomású CO2 oldódása után éri el a kívánt pH-t (7,3). Újabban a szén-dioxidot nem igénylő tápfolyadékokkal is kísérleteznek. Mivel a pH a sejttenyészet életképességének egyik legfontosabb tényezője, ennek könnyű ellenőrzése végett a tápoldat fenolvörös indikátort tartalmaz.
A szövetnedvben a sejtek által kibocsájtott, nagy fontosságú, részben még ma sem ismert felépítésű vegyületek (növekedési és differenciációs faktorok, citokinek, stb.) is vannak. Emiatt gyakran valamilyen élő szervezetből származó oldat - általában csirke, borjú vagy ló véréből kivont szérum- hozzáadására is szükség van.
A tenyésztés során a tápoldatot rendszeresen cserélni
kell, hiszen egyes vegyületeket a sejtek felhasználnak, ugyanakkor anyagcseréjük
vég- és melléktermékei felhalmozódnak. Fontos továbbá a termosztált tér
100%-os páratartalma is, mert a tápfolyadék párolgása révén annak töménysége
változhat. A tápoldat összeállításakor figyelembe kell venni, hogy az ozmolalitása
kb. 300 mOsm/kg H2O legyen. Ez sajnos a pufferkapacitás
korlátozottságát jelenti, hiszen az az oldott pufferek abszolút koncentrációjával
arányos.
2. Automatizált videomikroszkópos rendszer (1. ábra)
Ha a sejttenyészetek fejlődését folyamatosan szeretnénk mikroszkóp alatt vizsgálni, akkor kénytelenek vagyunk a szükséges feltételeket egy kisméretű inkubátorban megteremteni. A számítógép egy termisztor (elektronikus hőmérő) és néhány fűtőszál segítségével képes negatív visszacsatolással egy adott hőmérsékleten tartani a kamrát. A CO2 parciális nyomásával változik a tápoldat pH-ja, így a megfelelő gázutánpótlás szabályozását a számítógép elvégezheti egy pH-mérővel és a gázáramot kapcsoló mágneses szeleppel.

A mérés során a számítógép meghatározott időközönként
felvételeket készít a tenyészetről és a kamerából kiolvasott képet digitális
formában rögzíti. Ezt több képsíkban elvégzi, majd az egyes képek meghatározott
részletein kiszámítja az átlagszürkeséget, illetve az átlagtól való eltérést.
Minél nagyobb egy képen az így jellemezhető kontraszt, feltehetően maga
a kép annál élesebb (fokozottan igaz ez a fáziskontrasztos képek esetén).
Az így kiválasztott felvételekből a számítógép mozgófilmet készíthet. Sok
esetben ezek a filmek már önmagukban is új jelenségekre világítanak rá.
3. A fáziskontraszt eljárás
A fáziskontraszt eljárás lehetővé teszi egyformán átlátszó tárgyak olyan részleteinek a láthatóvá tételét, amelyek csak törésmutatójukban és/vagy vastagságukban különböznek egymástól.Ez számunkra azért fontos, mert sejtek átlátszósága nagyjából azonos, és legtöbbször csak festési eljárásokkal lehet az egyes részletek között különbséget tenni. A fáziskontraszt eljárás nem igényel festést, így a sejtek festetlen, nem fixált, élő állapotukban vizsgálhatóak. Ezért van ennek és a hasonló optikai eljárásoknak (DIC, Nomarsky) rendkívüli jelentősége a biológiai vizsgálatokban.
A hagyományos mikroszkóp képalkotásának elvét a 2. ábra mutatja be.
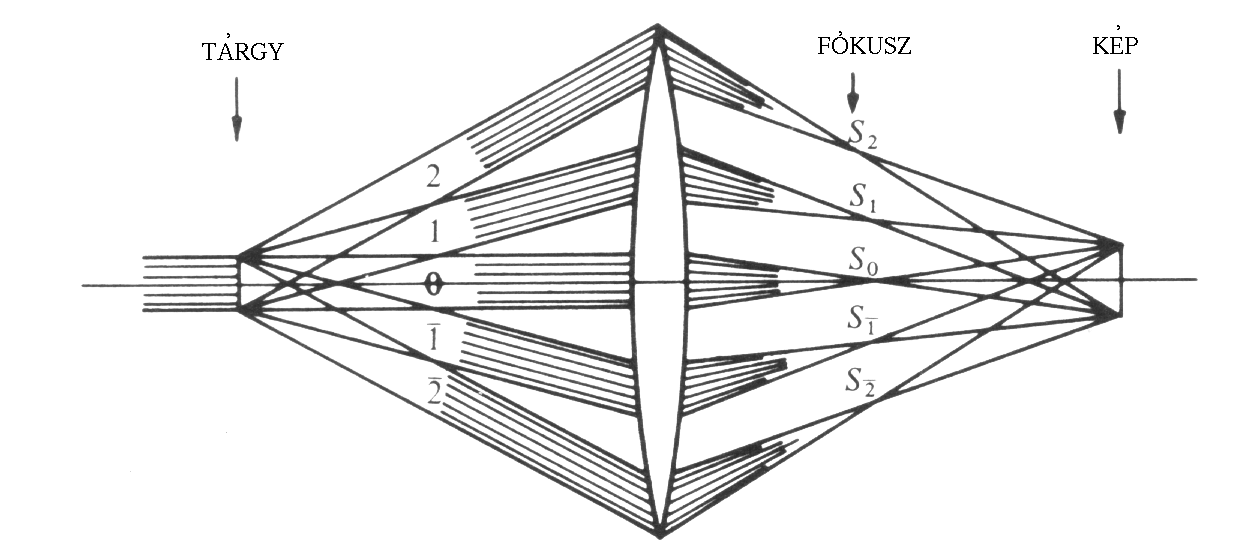
A mikroszkóp pontszerű fényforrásának a kondenzor által párhuzamosított fénynyalábja érkezik a tárgyra. A tárgyon a nyaláb egy része elhajlás nélkül halad át, míg a másik részét a tárgy inhomogenitásai elhajlítják. Mind az elhajlított, mind az el nem hajlított fényhullámok az objektívbe, a tárgylencsébe jutnak. Az objektív az el nem hajlított fényhullámokból a képoldali gyújtópontjában létrehozza a pontszerű fényforrás képét, míg az elhajlított fényhullámok a képoldali gyújtósík más pontjaiban gyűlnek össze. Mindezen képek, mint másodlagos fényforrások, egymással interferálva a tubus felső részében létrehozzák a szemlencsében látható képet.
A pontszerű fényforrás fényszegény képet ad, ezért a gyakorlatban kiterjedt fényforrásokat használnak. Legmegfelelőbbnek a gyűrű alakú mutatkozott. Így a lámpa fényét egy diszperzoron vezetik át, majd ezt a közel egyenletes fény egy olyan lemezen halad át, amely közepéből egy gyűrűt kivágtak. Természetesen így az el nem hajlított fényhullámokból a képoldali gyújtósíkban alkotott kép is gyűrű alakú lesz, ezért a fáziseltoló rétegnek is gyűrű alakúnak kell lennie, hogy tökéletesen fedje ezt a képet.
Az eljárás hátránya, hogy az azonos nagyítású fénymikroszkóphoz
képest némileg csökken a felbontása. A sejtek felszíne körül egy világos
udvar alakul ki, amely bizonyos esetekben zavaró (habár digitális képfeldolgozás
során esetleg előny is) lehet. Egy fáziskontraszt eljárással keszült felvétel
látható az alábbi fényképen. (A második
sejtmozi egy kockája.)
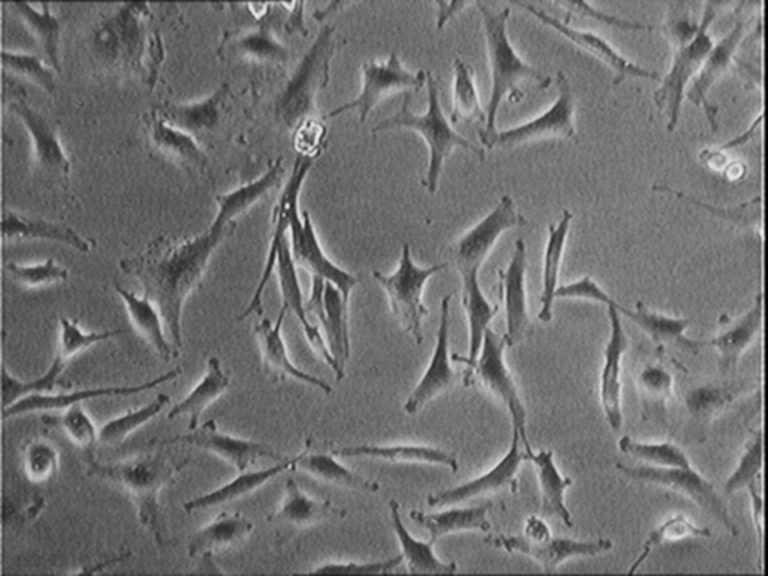
A felvételekből a számítógép
által összeállított filmek közül letölthetö néhány. (Ha a jobb oldali egér
gombbal kattintasz rá.) Mindhárom film a legrosszindulatúbb gliaeredetű
agydaganatban szenvedő három különböző páciensből származó sejttenyészetekről
készült.
1. sejtmozi
Az első filmen a sejtek inkább hámjellegűen növekednek, kevés nyúlvánnyal
rendelkeznek és viszonylag lassan mozognak.
2. sejtmozi
Ezek a sejtek már több nyúlványt növesztenek, alakjuk a migráló sejtekre
jellemző. A sejtek sebessége is nagyobb az elöző sejttenyészet sejtjeiénél.
3. sejtmozi
Ebben a tenyészetben a sejtek jellegzetes vándorló sejtalakot mutatnak,
igen nagy sebességgel mozognak, és egy bizonyos sejtsűrűség felett a sejtek
szinte áramlanak.
A filmek feldolgozásának első lépése, hogy meghatározzuk az egyes sejtek koordinátáit, illetve azt, hogy mikor jelentek meg vagy tüntek el a látótérből. Ennek automatizálása még csak gömbölyded, nem letapadt, úszó sejtek esetén megoldott, így a legtöbb tenyészetről egy embernek kell ezeket az adatokat felvennie. Az így létrehozott adatbázis a statisztikai feldolgozás nyersanyaga.
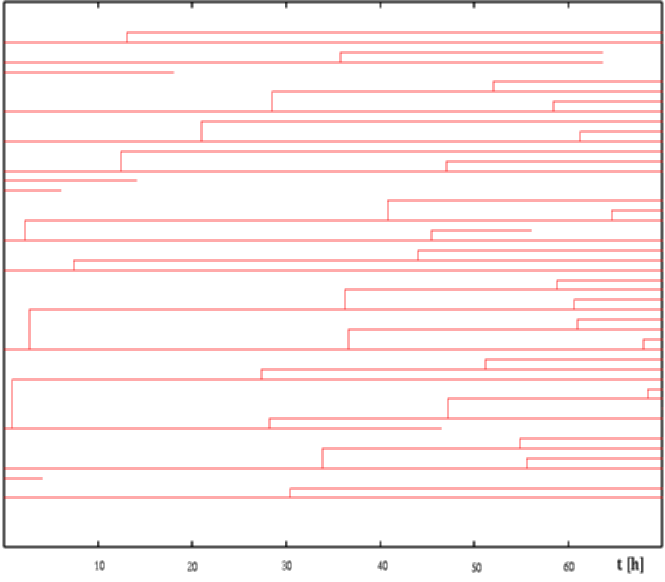
I. Trajektória
A nyers adatbázis felhasználásával kirajzoltatható az egyes sejtek, vagy akár a látótér összes sejtjének pályája (3. ábra). Ennek alapján egy szemléletes kép alakulhat ki a tenyészet mozgásáról.
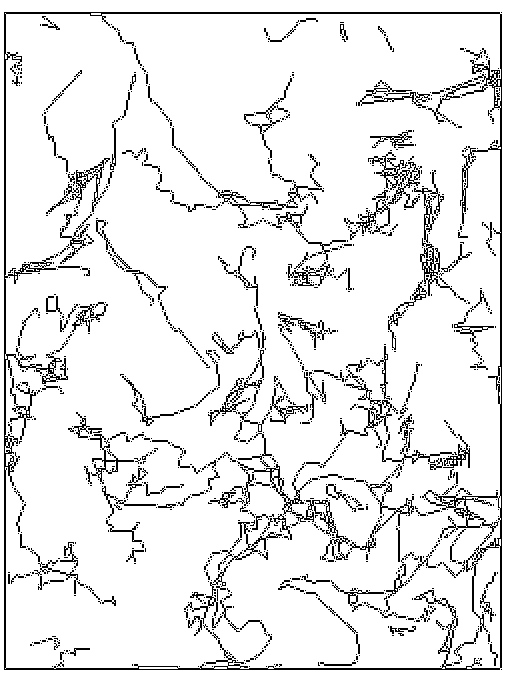
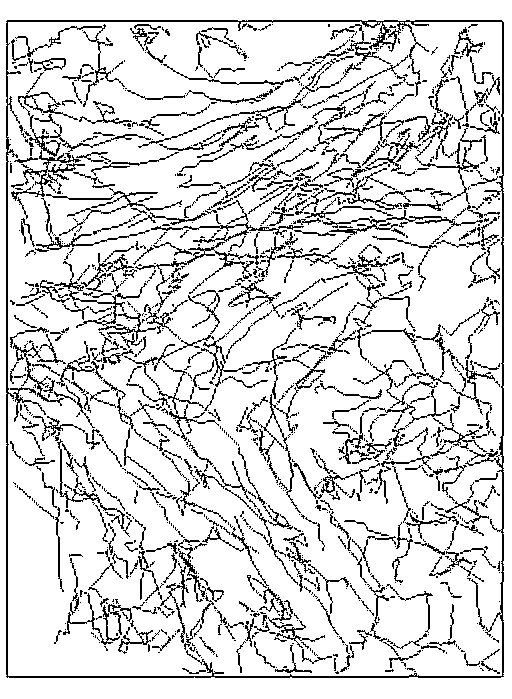
|
Ennek segítségével ábrázolhatjuk az idő függvényében,
mely sejtek tartózkodtak illetve osztódtak a látótérben (4.
ábra). Elegendően nagy családfa esetén az osztódási ciklus hossza
nagy pontossággal becsülhető, illetve a sejttenyészet osztódási aktivitásának
homogenitása is vizsgálható. Ez utóbbi például daganatok vizsgálatakor
lehet fontos kérdés.
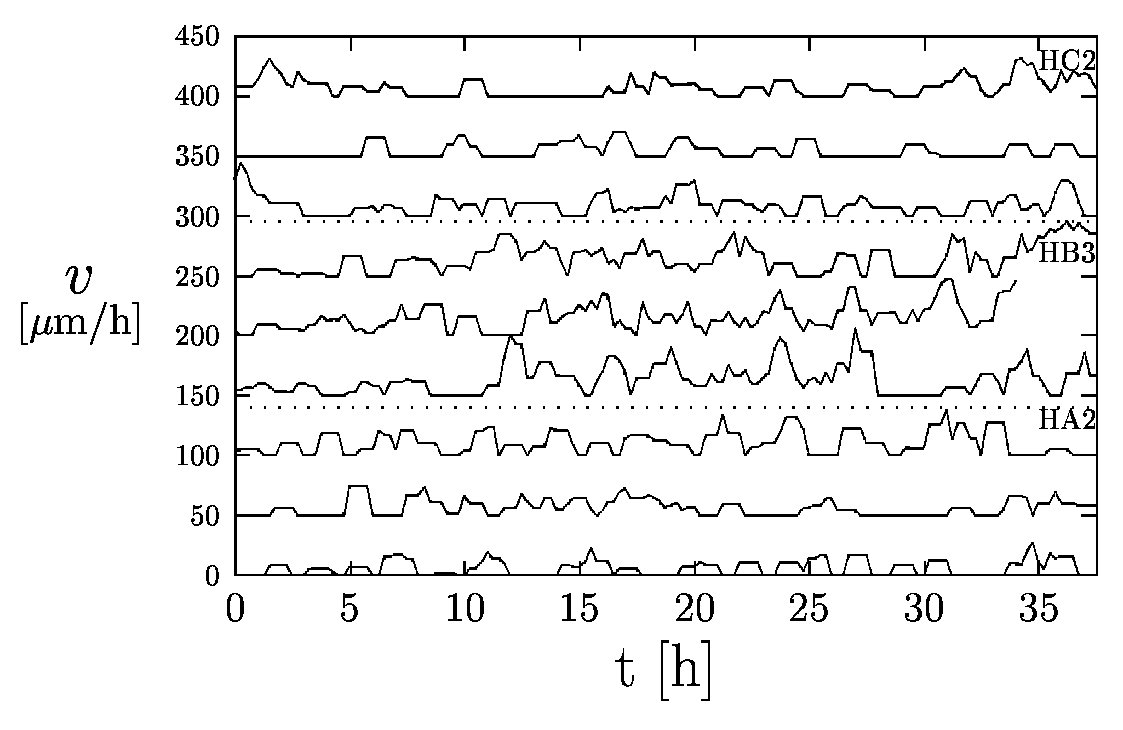
A digitalizálás során létrehozott adatokból ki lehet
számítani az egyes sejtek adott idő alatti elmozdulását, azaz a sebességét.
Ennek időbeli változásait demonstrálja a 5. ábra.
A nagyszámú adat birtokában a tenyészet statisztikus jellemzésére meghatározható:
(1) az egyes sejtek különböző nagyságú elmozdulásainak eloszlása
(6. ábra), (2) a látótér összes sejtjének
átlagsebessége vagy (3) ezeknek az átlagsebességeknek az eloszlása.
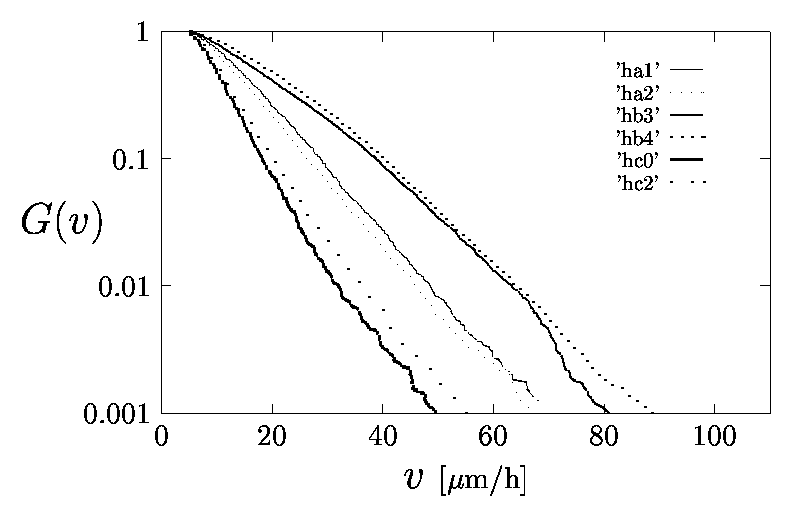
6.ábra Három azonos diagnózisú tumorból származó sejtvonalak 2-2 tenyészetének sebességeloszlása: G(v) megadja annak a valószínűségét, hogy egy véletlenszerűen kiválasztott sejt sebessége nagyobb lesz, mint v. Mint megfigyelhető, a sebességeloszlás reprodukálható és szignifikáns különbséget mutatott ki a három sejtvonal között.
IV. A kemotaxis vizsgálata
Az embrionális fejlődés során bizonyos sejtek hosszú vándorlás után más sejtekkel összekapcsolódva a későbbi szervek felépüléséhez szükséges sejtcsoportosulásokat alakítanak ki. Fontos feladat ezen folyamatok mechanizmusának megértése. Embrionális neuroektodermából származó tenyészeteken vizsgálható, vajon a sejtcsoportok kialakulásában szerepe lehet-e a kemotaxisnak. A mérési eredmények feldolgozásakor minden egyes sejt minden egyes elmozdulásakor kiszámítható az, hogy a többi sejt milyen távolságban és az elmozduláshoz képest milyen irányban található. Az összes sejtre vonatkozó eredményt egy koordinátarendszerben (,azaz minden egyes elmozdulást az x -tengely irányába forgatva,) ábrázolva egy felhő kapható (7. ábra).
5. A felhasználás lehetőségei
A sejttenyészetek in vitro számítógépes videomikroszkópiája
és az így nyert adatok statisztikus elemzése lehetőséget nyújt például
(i) a sejtmozgás modelljeinek kísérletes vizsgálatára, (ii) a sejtek helyváltoztatásával
szoros összefüggésben álló folyamatok modellrendszereinek kutatására (a
fehérvérsejtek mozgása az immunreakciókban, a sérülések utáni regenerációs
folyamatok, a már említett embrionális fejlődés során lezajló vándorlások),
(iii) különböző természetes és szintetikus vegyületek sejtmozgásra gyakorolt
hatásának vizsgálatára (gyógyszerkutatás), (iv) a dagantos betegségek kialakulásának
és az áttételképzés mechanizmusának a megértésére.